الحمض المرافق للقاعدة nh3 - حدد الحمض المرافق لمركب NH3
Recent Posts
- منصة الدعم والحماية الاجتماعية الضمان الاجتماعي
- اسئلة رياضيات ثاني متوسط
- الشلال اليوم النسائي
- معظم العناصر الموجودة على يسار الجدول الدوري هي ................
- قهوة الدهناء
- شرهة الغالي
- ما نوع التكاثر في الهيدرا ؟
- وحيد الدين خان
- عصير شمندر ندى
- محمد براك المطير
- وصف الكاتب شاشة الحاسوب امام ياسر
- من بنى حدائق بابل المعلقة
- من المواصفات الأداء الصحيح للخبرة مسكة المضرب الأصابع الثلاثة الأخرى توضع على النصل في الجهة الخلفية
- ديوان العز
- البوصلة الشخصية
- سبب العيون الحمراء التي تظهر في صور الأشخاص هو
- تيو
- محمد ناصر البخيتي
مذكرة الفصل الثالث الأحماض والقواعد مقرر كيمياء 4
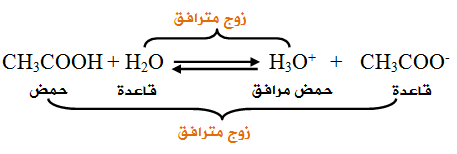
كذلك يُعد الماءُ في هذا التفاعل قاعدةً لأنه يستقبل بروتوناً من حمض الإيثانويك مُكوّناً حمضه المُرافق H 3O +.
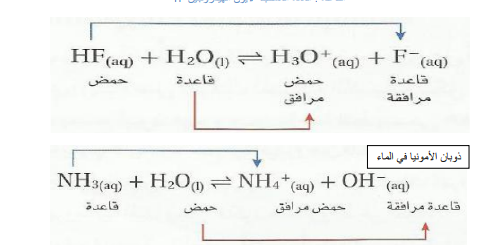
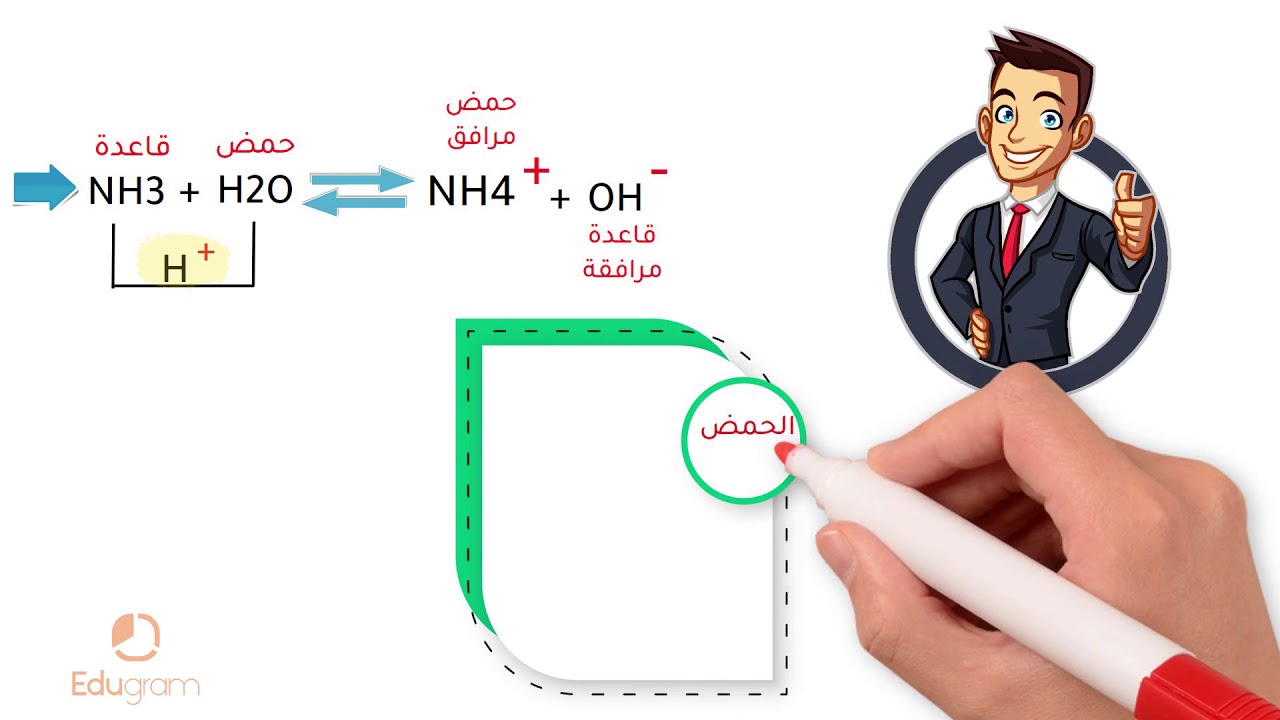
ـ نظرية برونستد ـ لوري في عام 1923 الكيميائي جوهان برونستد اقترح تعريف للأحماض و الأسس حيث : حم ض برونستد : هو الذي يميل لفقدان بروتون أو أكثر أساس برونستد : هو الذي يميل لأخذ بروتون أو أكثر شكل رقم 1 حمض برونستد و لوري تفقد بروتون أساس برونستد و لوري تكسب بروتون و نفس التعريف أعطي من طرف الكيميائي الإنكليزي طوماس لوري Thomas LoWry و بهذا سميت نظرية برونستد ـ لوري ، و هكذا نجد أن تفاعل حمض و أساس، بهذا المفهوم يعطي حمضا و أساسا جديدين و ذلك حسب العلاقة التالية : من المعادلة الكيميائية السابقة C تدعى الأسس و الأحماض الأزواج المترافقة، فالحمض 1 حمض مرافق للأساس 1 ، و كذلك الحمض 2 حمض مرافق للأ ساس 2 مث ا ل : و هكذا فإن الحمض يمكن أن يكون على شكل جز يء أو شاردة موجب ة أو شاردة سالب ة كما في المعادلات الكيميائية التالية : و عند انحلال غاز كلور الهيدروجين في الماء يصبح ناقلا جيدا للتيار الكهربائي كما في التجربة التالية شكل 4 تجربة ناقلية محلول مائي لحمض كلور الهيدروجين للكهرباء شكل رقم 4 عندما نضيف بضع قطرات من محلول مائي حمض كلور الهيدروجين إلى الماء الموجود في البشر نلاحظ احمرار سلك المصباح ، و يزداد سلك المصباح في التوهج حتى الإضاءة عندما نسكب بضع السنتمترات المكعبة من المحلول المائي كلور الهيدروجين ، أي أن محلول المائي لكلور الهيدروجين يتشرد كليا وفق المعادلة الكيميائية التالية :.
- Related articles
2022 forgiftsdirect.com